Giới thiệu về sự cân bằng trong hóa học
Trong lĩnh vực hóa học, khái niệm về sự cân bằng giữa các phản ứng hóa học đóng vai trò quan trọng trong việc hiểu và giải thích diễn biến của các phản ứng. Các phản ứng hóa học có thể xảy ra theo hai chiều: chiều thuận và chiều nghịch. Khi hệ thống đạt được trạng thái ổn định, tốc độ phản ứng thuận và phản ứng nghịch sẽ bằng nhau, và lúc này được gọi là trạng thái cân bằng. Tuy nhiên, trạng thái này không phải là cố định và có thể bị ảnh hưởng bởi nhiều yếu tố khác nhau.

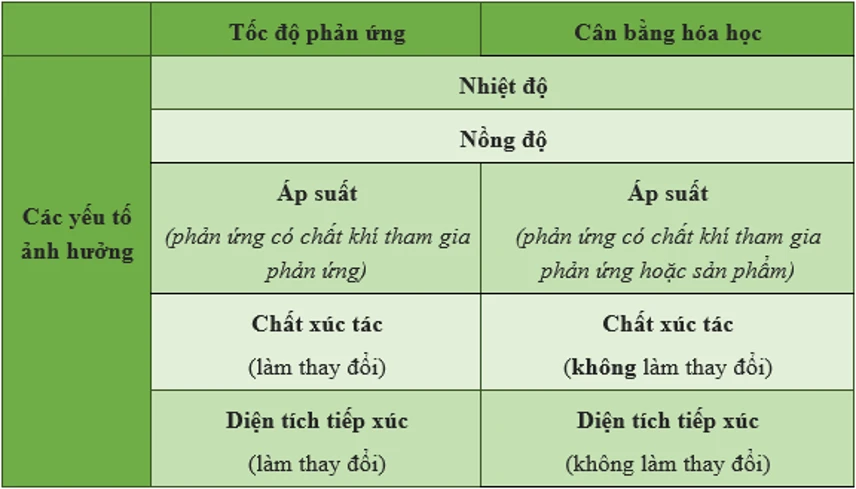
Các yếu tố ảnh hưởng đến trạng thái cân bằng hóa học
Để có thể duy trì và điều chỉnh trạng thái cân bằng, cần phải tìm hiểu về các yếu tố tác động đến hệ thống. Dưới đây là ba yếu tố chính thường ảnh hưởng đến sự cân bằng hóa học.
Nồng độ các chất trong phản ứng
Nồng độ của các chất tham gia phản ứng có ảnh hưởng trực tiếp đến tình trạng cân bằng. Khi nồng độ của một chất trong phản ứng tăng hoặc giảm, hệ thống sẽ tự động điều chỉnh để duy trì sự cân bằng. Cụ thể:
- Tăng nồng độ: Khi nồng độ của chất phản ứng tăng, theo nguyên lý Le Chatelier, cân bằng sẽ chuyển dịch theo chiều giảm nồng độ của chất đó. Ví dụ, trong phản ứng A + B ⇌ C + D, nếu nồng độ của A tăng, hệ thống sẽ chuyển dịch sang phải để tạo ra nhiều C và D hơn, từ đó làm giảm nồng độ của A.
- Giảm nồng độ: Ngược lại, khi nồng độ của một chất giảm, cân bằng sẽ chuyển dịch theo chiều thuận để bù đắp cho sự thiếu hụt của chất đó. Điều này cũng có thể xảy ra trong các phản ứng hóa học trong tự nhiên, chẳng hạn như trong quá trình quang hợp của cây xanh.

Nhiệt độ của hệ thống
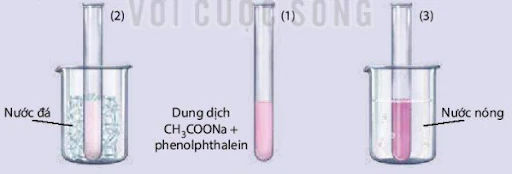
Nhiệt độ cũng là một yếu tố quan trọng ảnh hưởng đến trạng thái cân bằng. Nhiệt độ có thể thay đổi tốc độ phản ứng, từ đó tác động đến sự dịch chuyển của cân bằng:
- Tăng nhiệt độ: Khi nhiệt độ tăng, phản ứng nhiệt phân (thu nhiệt) sẽ xảy ra nhiều hơn, điều này có nghĩa là cân bằng sẽ chuyển dịch theo chiều thuận. Ví dụ, trong phản ứng A + B ⇌ C + D, nếu phản ứng này hấp thụ nhiệt, khi nhiệt độ tăng, cân bằng sẽ chuyển sang phải để tạo ra nhiều sản phẩm hơn.
- Giảm nhiệt độ: Ngược lại, khi nhiệt độ giảm, phản ứng tỏa nhiệt sẽ chiếm ưu thế hơn, và cân bằng sẽ chuyển dịch sang chiều nghịch. Điều này có thể được áp dụng trong nhiều quá trình công nghiệp, nơi việc kiểm soát nhiệt độ là rất quan trọng.

Áp suất trong hệ thống
Đối với các phản ứng hóa học có sự tham gia của các chất khí, áp suất là một yếu tố không thể bỏ qua. Sự thay đổi áp suất có thể ảnh hưởng đến sự chuyển dịch của cân bằng:
- Tăng áp suất: Khi áp suất được tăng lên, cân bằng sẽ chuyển dịch theo chiều mà số mol khí giảm. Điều này có nghĩa là nếu phản ứng có nhiều chất khí hơn ở phía bên trái (phản ứng thuận), cân bằng sẽ dịch sang phải (phản ứng nghịch) để giảm số mol khí trong hệ.
- Giảm áp suất: Khi áp suất giảm, cân bằng sẽ chuyển dịch theo chiều mà số mol khí tăng. Điều này cần được xem xét trong các quá trình công nghiệp liên quan đến khí, như trong sản xuất amoniac từ nitơ và hydro.
Những yếu tố khác và tác động của chúng
Ngoài ba yếu tố chính đã đề cập ở trên, còn có một số yếu tố khác có thể ảnh hưởng đến trạng thái cân bằng hóa học, mặc dù chúng không trực tiếp làm thay đổi vị trí của cân bằng.
Chất xúc tác
Chất xúc tác là một yếu tố quan trọng trong hóa học, tuy nhiên, nó không ảnh hưởng đến vị trí cân bằng mà chỉ tăng tốc độ phản ứng. Chất xúc tác có thể giúp các phản ứng diễn ra nhanh hơn mà không làm thay đổi lượng sản phẩm cuối cùng. Điều này có nghĩa là, mặc dù chất xúc tác có thể giúp hệ thống đạt đến trạng thái cân bằng nhanh hơn, nhưng nó không làm thay đổi vị trí của cân bằng.
Diện tích bề mặt
Diện tích bề mặt cũng có thể ảnh hưởng đến tốc độ phản ứng hóa học, nhưng nó không thay đổi vị trí của cân bằng. Một diện tích bề mặt lớn sẽ giúp tăng tốc độ phản ứng bằng cách tạo ra nhiều cơ hội cho các phân tử va chạm và tương tác với nhau. Tuy nhiên, điều này không có nghĩa là cân bằng sẽ dịch chuyển theo một chiều nào đó.
Kết luận
Trạng thái cân bằng hóa học là một trong những khái niệm cơ bản và quan trọng trong hóa học. Hiểu rõ các yếu tố ảnh hưởng đến trạng thái này không chỉ giúp chúng ta giải thích các hiện tượng hóa học mà còn hỗ trợ trong việc ứng dụng trong thực tiễn, từ ngành công nghiệp đến nghiên cứu khoa học. Các yếu tố như nồng độ, nhiệt độ, áp suất, chất xúc tác và diện tích bề mặt đều có vai trò nhất định trong việc duy trì và điều chỉnh sự cân bằng của các phản ứng hóa học.
Sự hiểu biết sâu sắc về những yếu tố này sẽ giúp bạn không chỉ trong học tập mà còn trong việc áp dụng kiến thức hóa học vào thực tế. Hãy luôn ghi nhớ rằng, mặc dù một số yếu tố không trực tiếp ảnh hưởng đến vị trí cân bằng, nhưng chúng vẫn có thể làm thay đổi tốc độ phản ứng, từ đó giúp hệ thống đạt được trạng thái cân bằng một cách hiệu quả hơn.